原子の発見のプロセス
- デモクリトス(古代ギリシャ) – 原子の存在を予見
- ドルトン(英国、1800) – 原子論を化学の分野に適用
- クルックス(イギリス、19世紀末) – 陰極線管を発明して、電子の各種現象を説明
- ラザフォード(イギリス、1909) – 原子核の存在を確認
- J。 J.トムソン(イギリス、1897) – 陰極線管の実験を通じ、電子の存在を確認
- N。ボーア(デンマーク、1913) – 原子の惑星仮説を提起
- A。 N.ボーア(デンマーク、1922) – 原子核の形を説明
- ルイ・ド・ブロイ(フランス、1923) – 電子粒子の波動性提起
- シュレーディンガー(オーストリア、1926) – 原子の電子軌道を数学的に解明
- ハイゼンベルク(ドイツ、1927) – 不確定性原理を通じた電子軌道の安定性を説明
- R。ファインマン(アメリカ、1965) – 量子エレクトロニクス力学を研究
- IBM(アメリカ、1990) – 原子を見ることができる顕微鏡を制作、原子を粒子単位で移すことに成功
原子模型
原子は、どの形態をしていますか?小さすぎて見ることができない原子の目に見えるならば、どのような形をしているか示したものを原子模型と呼びます。原子模型は以下のように変遷してきました。
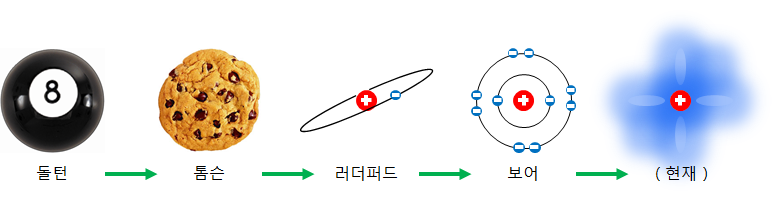
原子をよく知らなかった頃、原子はまるでビリヤードボールのように固い塊であると思いました。しかし、実際の原子は電子と原子核に分割されることができ、粒子加速器を使用すると、原子核も裂くことができます。
約200年前、原子は、まるでレーズンがついているマフィンと似ているだろうと想像しました。マフィンの表についているレーズンは電子で例えることができます。原子内の(+)電荷は全体積の中に均一に広がっており、電子(レーズン)は電荷の球(マフィン)の中で、固定点を中心に振動していると考えています。
実際に原子の大部分がガラガラ空であることは、100年前のラザフォードが発見しました。
そして、ニールスボーアはもっと補完された原子モデルを提案しました。ボーアの原子模型は最近に見ることができる原子模型と多くの近接しました。ボーアの原子模型で電子は与えられた軌道を回っています。この模型は、電子が原子核の周りを回っている姿が、まるで太陽の周りを回っている惑星に似たので、惑星模型とも呼ばれます。
現在、原子核の周りの電子は、物質と波動の性質を同時に持っており、電子の位置と速度は正確に知ることができがなく、唯一の統計的な確率のみ把握することができていると言われています。
ラザフォードとボーア原子模型の欠点
ボーアの古典的な物理の概念から見ると、一軌道で加速された電子は、光を放出します。このとき、失われたエネルギーのせいで軌道速度が減って、電子が核にらせん状に衝突するようになっています。しかし、このような現象は起こりません。なぜでしょうか?
(Conceptual physics 7th Edition – Paul G. Hewitt)
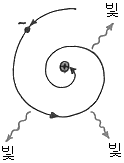
電子がまばらなエネルギー準位を持つ理由
ド・ブロイ(de Broglie)は、1924年にド・ブロイ波の概念を紹介しました。すべての粒子は、自分の運動量に反比例する波長を持つ波動という仮説を提唱しました。物質がすぐに波長という話です。
物質波の他の種類の波動と同じように行動します。反射され、屈折され、また、回折され、干渉現象を示しています。ド・ブロイ波の干渉からド・ブロイはボーアの軌道は、電子波動の定常波から自然に導出されることを示しました。ボーアの電子軌道は、電子波動の波長が円軌道周囲の整数倍と全く同じであるときに存在します。この方法で継続的に補強干渉を起こします。
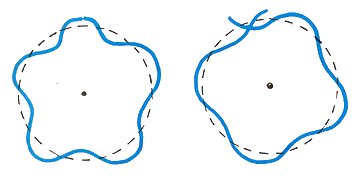
ド・ブロイの原子模型の軌道の電子が定常波を形成するときは、円周の長さが、電子の波動の波長の整数倍である場合です。(左)
波動が整数倍の波長がされていなければ、消滅干渉を起こします。(右)
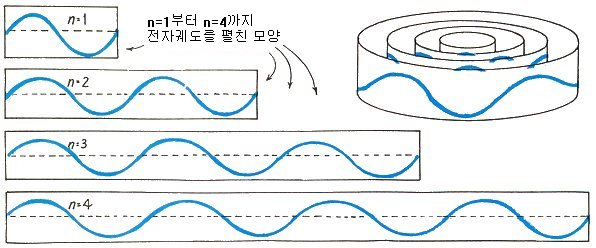
原子の電子軌道はまばらな半径を持っており、その理由は、軌道円周が電子波動の波長の整数倍に与えられるからです。元素に応じて、電子波動の波長が異なり、軌道も異なります。上の図は、簡略化して表現したものです。
(Conceptual physics 7th Edition – Paul G. Hewitt)