- 모든 원자 모형은 최외각 껍질의 전자만 표시되었습니다.
- 모든 화학 결합은 평면으로 묘사되었으나, 실제로는 3차원 구조를 가질 수 있습니다.
- '불안정한 결합인 경우 빨간색으로 표시하는 기능'은 오류가 있을 수 있습니다.
화학 결합
18족의 비활성 기체를 제외한 원자는 불안정하기 때문에 다른 원자와 결합된 상태로 존재합니다. 이때, 대부분 원자들은 옥텟 규칙을 이루는 방향으로 결합하려 합니다.
옥텟 규칙(Octet Rule)
옥텟 규칙(또는 8전자 규칙)은 원자가 안정된 상태로 존재할 수 있는 경험적 규칙입니다. 즉, 분자를 이루는 각각의 원자는 최외각 껍질에 8개의 전자를 가질 때 가장 안정된 상태가 된다는 것입니다.
다만, 옥텟 규칙에는 몇 가지 예외가 있습니다.
- 가장 안쪽 껍질은 전자가 2개이면 안정됩니다. 예를 들어 원자번호 1번 수소는 전자를 하나만 얻으면 안정되며, 3번 리튬은 전자를 하나만 잃어 버리면 안정됩니다. 참고로 2번 헬륨은 세상에서 가장 안정적인 원자입니다.
- 3주기부터는 옥텟 규칙을 만족하지 않아도 안정적으로 존재하는 물질들이 등장합니다. (예: H2SO4 (황산), H3PO4 (인산) 등)
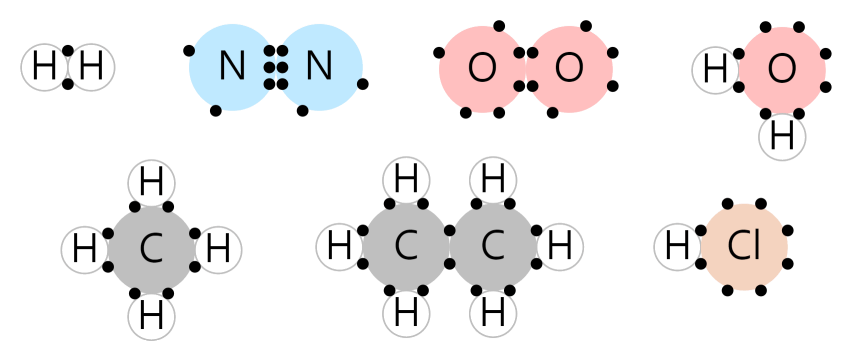
공유 결합
공유 결합은 원자들이 전자를 서로 공유하면서 옥텟 규칙을 만족하는 경우입니다.
아래 그림은 공유 결합의 예시입니다. 원자 사이에 끼워져 있는 전자들이 공유 전자들입니다. 공유된 전자를 포함한 전자를 각각 세어보면, 수소는 2개, 나머지 원자들은 8개씩이라는 것을 알 수 있습니다.
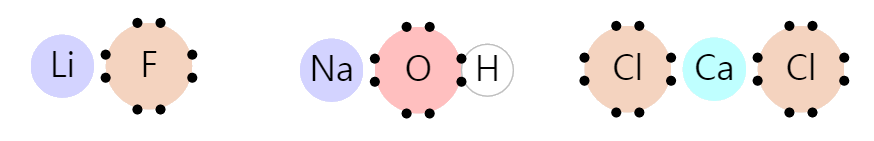
이온 결합
이온 결합은 전자를 다른 원자에게 일방적으로 제공하면서 옥텟 규칙을 만족하는 경우입니다.
원자의 최외각 전자가 3개 이하인 경우, 옥텟 규칙을 만족하기 위해서는 5개 이상의 전자를 모아야 합니다. 이 경우에는 많은 수의 전자를 모으는 대신, 얼마 안되는 전자를 내보내는 편이 유리하기 때문입니다.
아래 그림은 이온 결합의 예시입니다. 리튬(Li), 나트륨(Na), 칼슘(Ca)은 이웃한 원자에게 전자를 제공합니다. 리튬(Li), 나트륨(Na), 칼슘(Ca)은 최외각 전자를 모두 덜어내었으며, 이웃한 원자들은 옥텟 규칙을 만족합니다.