원자의 발견 과정
- 데모크리토스(고대 그리스) – 원자의 존재를 예견
- 돌턴(영국, 1800) – 원자론을 화학분야에 적용
- 크룩스(영국, 19세기말) – 음극선관을 발명하여 전자의 각종 현상을 설명
- 러더퍼드(영국, 1909) – 원자핵의 존재를 확인
- J. J. 톰슨(영국, 1897) – 음극선관 실험을 통해 전자의 존재 확인
- N. 보어(덴마크, 1913) – 원자의 행성 가설 제기
- A. N. 보어(덴마크, 1922) – 원자핵의 모양 설명
- 드브로이(프랑스, 1923) – 전자 입자의 파동성 제기
- 슈뢰딩거(오스트리아, 1926) – 원자의 전자 궤도를 수학적으로 규명
- 하이젠베르크(독일, 1927) – 불확정성 원리를 통한 전자궤도의 안정성 설명
- R. 파인먼(미국, 1965) – 양자전자역학 연구
- IBM(미국, 1990) – 원자를 볼 수 있는 현미경 제작, 원자를 입자 단위로 옮기는데 성공
원자 모형
원자는 어떤 모양을 하고 있을까요? 너무 작아서 볼 수 없는 원자가 눈에 보인다면 어떤 모양을 하고 있을지 나타낸 것을 원자 모형이라고 합니다. 원자 모형은 아래와 같이 변천되어 왔습니다.
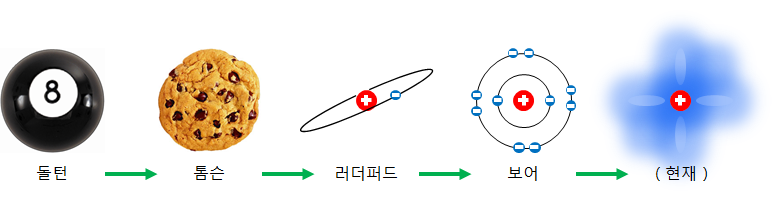
원자에 대해 잘 모르던 시절, 원자는 마치 당구공처럼 단단한 덩어리일 것이라고 생각했습니다. 하지만 실제 원자는 전자와 원자핵으로 쪼개질 수 있으며, 입자가속기를 사용하면 원자핵도 쪼갤 수 있습니다.
약 200년전, 원자는 마치 건포도가 붙어 있는 머핀과 비슷할 것이라고 상상되었습니다. 머핀의 겉에 붙어 있는 건포도는 전자로 비유될 수 있습니다. 원자 내의 양전하들은 전체 부피내에 골고루 퍼져 있으며, 전자(건포도)들은 전하의 구(머핀)내에서 고정점들을 중심으로 진동하고 있는 것으로 생각되었습니다.
실제로 원자의 대부분이 텅 비었다는 것은 100년 전 러더퍼드가 발견하였습니다.
그 후에 닐스 보어는 좀더 보완된 원자 모형을 제시하였습니다. 보어의 원자모형은 요즘 볼 수 있는 원자모형과 많이 근접하였습니다. 보어의 원자 모형에서 전자는 주어진 궤도를 돌고 있습니다. 이 모형은 전자가 원자핵 주변을 돌고 있는 모습이 마치 태양 주변을 돌고 있는 행성을 닮았기 때문에 행성모형이라고도 부릅니다.
현재, 원자핵 주위의 전자는 물질과 파동의 성질을 동시에 가지고 있으며, 전자의 위치와 속력은 정확히 알 수가 없으며, 통계적인 확률로만 파악할 수 있다고 알려져 있습니다.
러더퍼드와 보어 원자 모형의 단점
보어의 고전물리의 개념에서 보면 한 궤도에서 가속된 전자는 빛을 방출합니다. 이 때 잃어버린 에너지 때문에 궤도 속력이 줄어서 전자가 핵에 나선형으로 충돌하게 되어 있습니다. 그러나 이러한 현상은 일어나지 않습니다. 왜 일까요?
(Conceptual physics 7th Edition – Paul G. Hewitt)
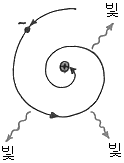
전자가 띄엄띄엄한 에너지준위를 가지는 이유
드브로이(de Broglie)는 1924년에 물질파의 개념을 소개했습니다. 모든 입자는 자신의 운동량에 반비례하는 파장을 가진 파동이라는 가설을 제창했습니다. 물질이 곧 파장이라는 이야기 입니다.
물질파는 다른 종류의 파동과 똑같이 행동합니다. 반사되고, 굴절되고 또한 회절되며 간섭현상을 보여줍니다. 물질파의 간섭으로부터 드브로이는 보어의 궤도는 전자파동의 정상파로부터 자연적으로 도출된다는 것을 보였습니다. 보어의 전자 궤도는 전자파동의 파장이 원궤도 둘레의 정수배와 같을 때 존재합니다. 이러한 방법으로 계속적으로 보강간섭을 일으킵니다.
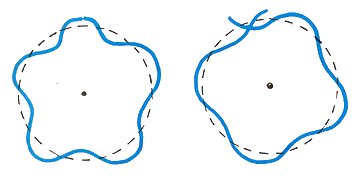
드브로이의 원자 모형 궤도전자가 정상파를 만들 때는 원둘레의 길이가 전자파동 파장의 정수배인 경우입니다.(왼쪽)
파동이 정수배의 파장으로 원둘레를 완전히 둘러쌓지 못하면 소멸간섭을 일으킵니다.(오른쪽)
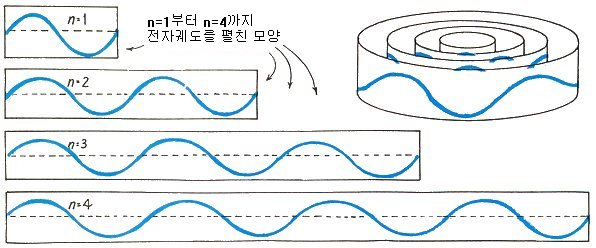
원자의 전자궤도는 띄엄띄엄한 반지름을 가지고 있으며, 그 이유는 궤도 원둘레가 전자파동의 파장의 정수배로 주어지기 때문입니다. 원소에 따라 전자파동의 파장이 다르고 궤도도 다릅니다. 위 그림은 단순화하여 표현한 것입니다.
(Conceptual physics 7th Edition – Paul G. Hewitt)